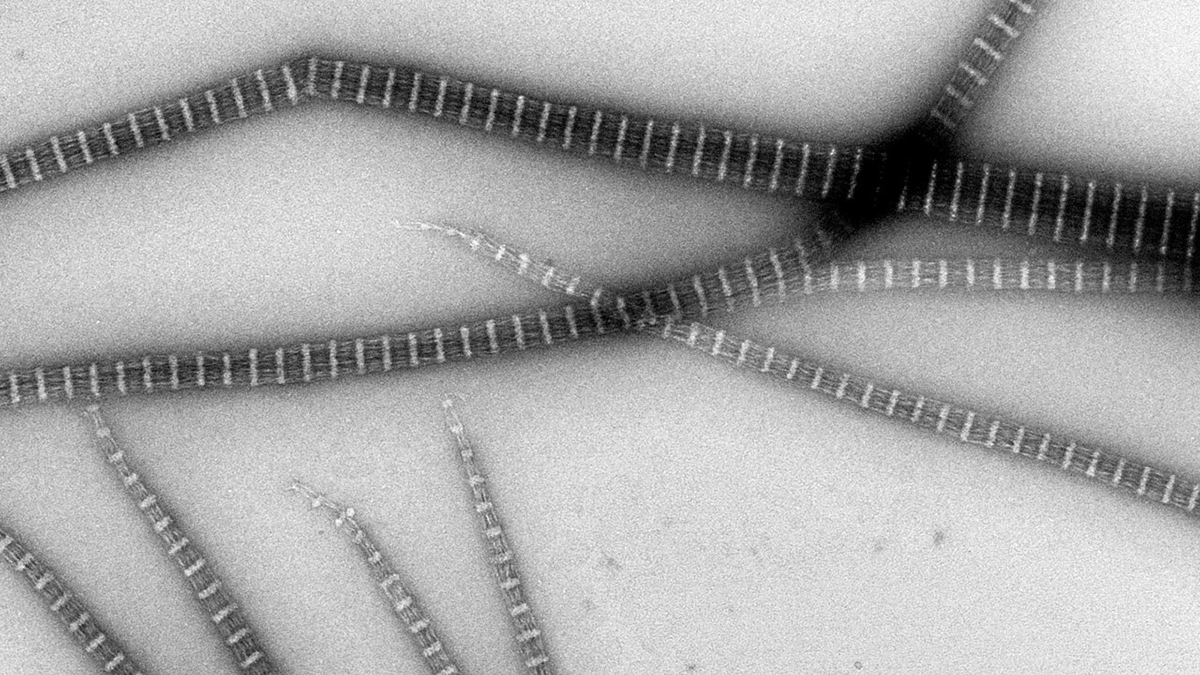
Med hjälp av nya kraftfulla elektronmikroskop har forskare vid Umeå universitet avbildat Streptomyces-bakterier som skapar långa trådar och nätverk för att kunna växa och stabilisera sin form. Bakterien är en potentiell guldgruva för produktion av antibiotika.
Dessa fantastiska bakterier har förmodligen fler typer av antibiotika vi kan utvinna om vi lär oss odla dem på alternativa sätt, menar Linda Sandblad, forskare på Kemiska institutionen och samordnare för Umeå Core Facility for Electron Microscopy vid Umeå universitet, som nu visar hur den bildar trådar och skapar 3D-nätverk.
– Det är första gången vi eller någon annan analyserar hur streptomyces-protein bildar filament och första gången streptomyces-proteinfilament studeras tredimensionellt.
Protein blixtfryst i amorf is
Med hjälp av nya kraftfulla elektronmikroskop har Linda Sandblad och hennes kollegor tagit tredimensionella bilder av proteinfilament med nanometerupplösning. De använder en metod som kallas Cryo-EM, vilket innebär att proteinprovet är blixtfryst i en amorf is. Till skillnad från is som kyls långsamt har en amorf is ingen kristallstruktur och det möjliggör avbildning av proteiner i vattenlösning med elektronmikrosko.

Proteinet i fråga kallas FilP. Som namnet antyder kan proteinet bilda så kallade filament, långa trådar, med varierande struktur. FilP är ett cytoskelettprotein från bakterien Streptomyces coelicolor. Cytoskelettets funktion är att hålla upp cellen och ge den deras form. Cytoskelettet är också betydelsefullt för att cellerna ska kunna anpassa sin form och röra sig – på så sätt kan celler vara både stabila och elastiska på samma gång.
Streptomyces är ett intressant släkte bakterier som bildar multicellulära hyfer i jord och vatten. Där fyller bakterien en viktig funktion som nedbrytare av organiska material, och forskargruppen har tidigare upptäckt att FilP binder till cellulosa. Vi människor använder Streptomyces-bakterier för att producera antibiotika.
Trådarna blir längre i sur miljö
FilP liknar djurcellers intermediärfilamentprotein och kan bilda filamentösa strukturer i andra bakterier och i provrör.
– I vår studie renade vi proteinet för att sedan kontrollera hopsättningen till filament och nätverk i provrör, säger Linda Sandblad.
I en sur miljö blir proteininteraktionerna och filamenten längre och tjockare och i en basisk miljö är filamenten tunnare och krokigare. I en miljö som innehåller olika typer av salt, med saltkoncentrationer som liknar bakterier och cellers intracellulära miljö kan FilP forma nätverk. Ett nätverk i tre dimensioner (3D) kan mekaniskt förklara hur proteinet FilP kan stabilisera cellens struktur inifrån och påverka hur bakteriens hyfer växer och formas.
– Cryo-EM ger oss nya möjligheter att studera cellers struktur i en mer naturlig miljö och Umeå universitet satsar på att göra denna metod tillgänglig för både biologisk och medicinsk forskning. Det finns ett stort intresse för användning av elektronmikroskop i Sverige och hela världen idag!
Vetenskaplig artikel:
Javadi A, Söderholm N, Olofsson A, Flärdh K, Sandblad L. Assembly mechanisms of the bacterial cytoskeletal protein FilP. Life Sci Alliance.
Kontakt
Linda Sandblad, Kemiska institutionen vid Umeå universitet, linda.sandblad@umu.se