Dålig timing av proteiner kan hindra Yersinia-infektion
Sofie Ekestubbe visar i sitt avhandlingsarbete hur viktigt samspelet mellan specifika proteiner är för att bakterien Yersinia ska kunna etablera, överleva och utveckla infektionssjukdom hos djur och människa.
– Min forskning ger ny kunskap om hur bakteriens Typ III sekretionssystem (T3SS) fungerar och kan komma till nytta vid utveckling av nya behandlingsmetoder mot bakterier som förlitar sig på detta system för infektion, säger Sofie Ekestubbe.
En del sjukdomsframkallande bakterier som infekterar djur och människor kan orsaka livshotande infektioner. Den ständigt ökande antibiotikaresistensen hos många av dessa bakterier gör att vi måste finna nya sätt att förhindra infektion.
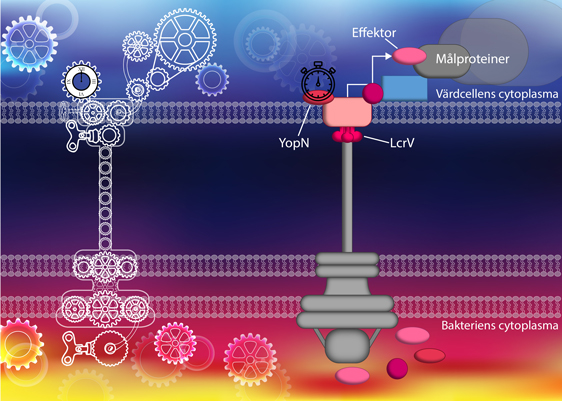
Nanofabriken. T3SS är en komplex maskin som regleras på flera olika nivåer. Likt kuggar i ett maskineri samarbetar alla delarna i systemet för att leverera effektorer in i en värdcell med syfte att blockera processer i värdcellen. Bild: Sofie Ekestubbe
Genom att i detalj studera de specifika mekanismer som sjukdomsframkallande bakterier använder för att etablera infektion får vi nya möjligheter att blockera dessa bakteriers infektionsförmåga utan att döda dem vilket minskar selektionstrycket för att bakterierna utvecklar resistens.
T3SS-systemet en invecklad ”nanofabrik”
Typ III sekretionssystemet (T3SS) är en mekanism som många sjukdomsframkallande bakterier, till exempel Salmonella, Shigella och Yersinia, använder för att infektera djur och människa. Systemet är som en invecklad ”nanofabrik” och består av en sekretionsapparat med en kanal som levererar giftiga proteiner, så kallade effektorer, direkt in i specifika celler hos värddjuret.
Sofie Ekestubbe har använt sig av Yersinia pseudotuberculosis som modellorganism för att studera T3SS och i sin avhandling har hon studerat hur leveransen av de giftiga effektorerna in i värdcellerna regleras.
Y. pseudotuberculosis infekterar oss i magtarmkanalen via kontaminerad mat eller vatten och använder sitt T3SS för att paralysera våra immunförsvarsceller för att på så sätt överleva och sprida sig. Flera proteiner samarbetar för att säkerställa att effektorerna levereras omedelbart när bakterien har bundit till en värdcell, samt att de dirigeras till sina målproteiner inuti värdcellen.
Timing mellan proteinerna ett måste för infektion
Innan Y. pseudotuberculosis har bundit till en värdcell hålls sekretionsapparaten inaktiv av två separata proteinkomplex. Det ena komplexet blockerar själva sekretionskanalen medan det andra komplexet blockerar produktionen av de giftiga effektorerna. När bakterien binder till en värdcell löses de här proteinkomplexen upp och systemet kan då leverera effektorerna in i värdcellen.
Sofie Ekestubbe visar i sin forskning att proteinerna LcrV och LcrG i det ena komplexet och YopD från det andra komplexet samspelar. Interaktionen mellan dessa proteiner kan vara en viktig del i regleringen. Hennes resultat visar också att två av proteinerna, LcrV och YopN, som är viktiga för regleringen inne i bakterien också medverkar till att effektorerna levereras in i värdcellen och snabbt dirigeras till sina målproteiner.
– Det betyder att LcrV och YopN behövs för att timingen ska fungera, vilket är avgörande för att Y. pseudotuberculosis ska kunna etablera en infektion, överleva och tillväxa i det infekterade värddjuret.
Om disputationen: Fredagen den 27 januari försvarar Sofie Ekestubbe, Institutionen för molekylärbiologi, sin avhandling med titeln: Timing and targeting of Type III secretion translocation of virulence effectors in Yersinia. Svensk titel: Timing och targeting vid translokering av virulenseffektorer via Typ III sekretionssystemet i Yersinia. Disputationen äger rum klockan 9.00 i N200, Naturvetarhuset.
Fakultetsopponent är Dr. Kurt Schesser, Institutionen för mikrobiologi och immunologi, Miller school of medicine, University of Miami, Miami, USA
Handledare är Professor Åke Forsberg
Kontakt: Sofie Ekestubbe, Institutionen för molekylärbiologi
Telefon: 070-7485395 E-post: Sofie.ekestubbe@umu.se eller Sofie.v.ekestubbe@gmail.com
Sofie Ekestubbe är född och uppvuxen i Halmstad. Där studerade hon naturvetenskaplig inriktning på gymnasiet och arbetade några år innan hon flyttade till Umeå för att studera molekylärbiologi.




