
Genmutation kopplad till ovanlig Västerbottenssjukdom
En genmutation ligger bakom den ovanliga ärftliga blodsjukdomen CDA III, även kallad Västerbottensanemin. Genen – KIF23 – spelar en central roll i den process som styr celldelningen, enligt en ny avhandling från Umeå Universitet.
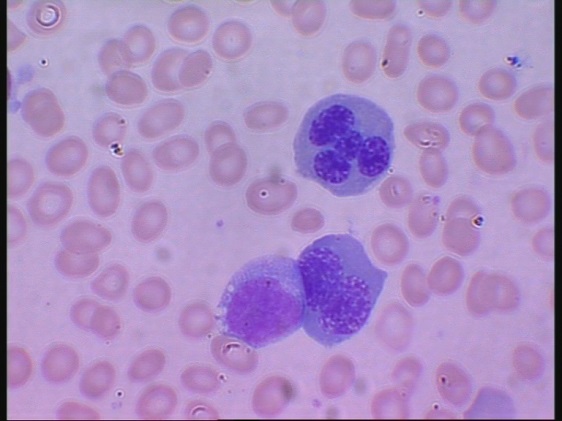
CDA III (Kongenital Dyserytropoetisk Anemi typ III) är en form av ärftlig blodbrist där bildningen av röda blodkroppar är kraftigt förändrad och de röda blodkropparnas livslängd förkortad (så kallad hemolytisk anemi).
– Västerbottensanemin är en ovanlig sjukdom men kan tjäna som en viktig modell för såväl cancerutveckling som andra ärftliga hemolytiska anemier, vilka globalt sett utgör mycket vanliga tillstånd, säger Maria Liljeholm, som är doktorand vid Institutionen för strålningsvetenskaper och författare av avhandlingen.
– Dessutom är det viktigt att även människor med ovanliga sjukdomar kan erbjudas utredning, uppföljning och behandling med vetenskapligt stöd.
Av ungefär 70 rapporterade fall av CDA III i hela världen härstammar knappt 50 från en släkt med rötterna i Västerbotten. Symtomen vid Västerbottensanemin är framförallt trötthet och nedsatt kondition. I några fall kompliceras blodbristtillståndet av en störd järnomsättning, vilket kan leda till lagring av järn i inre organ och i värsta fall organsvikt i framförallt hjärta och lever.
Genen viktig i celldelningens slutfas
– Vår forskning visar att det är en mutation i KIF23-genen, som orsakar Västerbottensanemin. Denna gen spelar en central roll i celldelningens slutfas. Genmutationen gör att celldelningen inte avslutas korrekt, vilket resulterar i de flerkärniga celler som kännetecknar CDA III, säger Maria Liljeholm.
– Vi vet att störd celldelning är en grundläggande förutsättning för cancerutveckling och att det vid CDA III finns en ökad risk att utveckla blodcancerformen myelom. Vi kommer därför fortsätta att undersöka om mutation i KIF23 även kan ge ökad risk för annan cancerutveckling. Det finns studier som visar att genen är aktiv vid olika cancerformer, men mer forskning behövs för att undersöka om genen driver, eller är en markör, för cancer.
Avhandlingen visar också att det genetiska anlaget för den ärftliga järnomsättningssjukdomen Hereditär Hemokromatos förekommer hos en majoritet av personerna i den västerbottniska släkt som förknippas med CDA III. I sin avhandling visar Maria Liljeholm att en enda uppsättning av den så kallade hemokromatosgenen räcker för att personer med CDA III ska ha en negativ påverkan på järnomsättningen. Fyndet visar att det är viktigt att beakta Hereditär Hemokromatos vid ärftliga hemolytiska blodbristsjukdomar såsom CDA III, eftersom hemokromatosgenen kan leda till järninlagring i inre organ, ett tillstånd som, om det inte behandlas, kan leda till organskador.
Fotnot: Maria Liljeholm är från Markaryd. Hon arbetar som överläkare vid Cancercentrums Hematologisektion på Norrlands Universitetssjukhus (NUS) och är också doktorand vid Institutionen för Strålningsvetenskaper vid Umeå universitet.
För mer information:
Maria Liljeholm, Institutionen för strålningsvetenskaper, Umeå universitet.
Telefon: 090-785 21 64 ;073-821 9948
e-post: maria.liljeholm@vll.se




