
Organoider – levande modeller av mänskliga organ – ger forskarna en detaljerad bild av våra cellers inre liv. På Karolinska institutet används organoider just nu för att ta fram läkemedel mot det nya coronaviruset.
Det är svårt att se vad som händer inuti en människa. Om man till exempel vill se hur vävnader reagerar när vi angrips av virus eller bakterier, hur en tumör sprider sig i kroppen – och till och med hur hjärnan utvecklas.
Organoiden är ett mångsidigt verktyg för forskningen, som blivit möjlig tack vare stamceller, celler som kan styras till att bli – nästan – vad man vill.
Hudceller blir hjärnceller
Anna Falk, forskare vid Karolinska institutet i Stockholm, har ett skåp på sitt laboratorium där hon odlar små hjärnor, eller snarare modeller av hjärnor – organoider. Hon plockar försiktigt ut en av skålarna och visar hur små gråvita korn flyter runt i en näringslösning. De här cellklumparna använder hon för att studera hur hjärnan utvecklas hos olika individer.
– Vi tar en pytteliten bit hud från en person, och sen programmerar vi om hudcellerna till stamceller. De här stamcellerna kan sen styras om till att bli nästan alla typer av celler i hela kroppen, så vi förvandlar dem till nervceller eftersom vi är intresserade av hjärnan. Nervcellerna organiserar sedan sig själva i näringslösningen i olika lager på ett sätt som liknar hjärnans uppbyggnad, förklarar Anna Falk.
Organoider – cellklumpar som imiterar ett riktigt organ
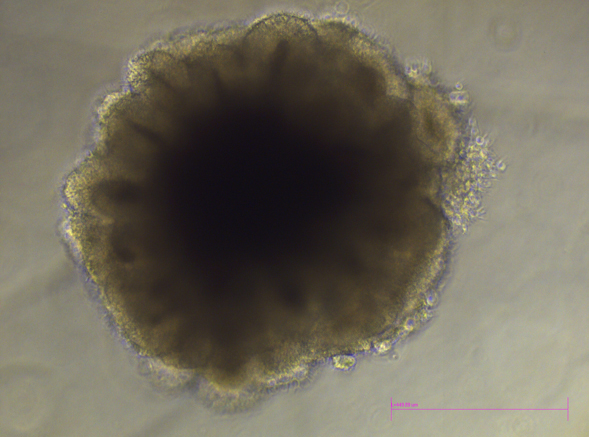
Organoider är små självorganiserade ansamlingar av flera tusentals celler som på flera sätt liknar ett riktigt organ, fast i mindre skala. De är uppbyggda av stamceller som kan odlas i laboratoriet och som kan förvandlas till helt nya celltyper.
Numera kan forskare skapa organoider som är modeller av hjärnan, njuren, lungan, tarmen och levern med flera organ. Organoiderna ger forskare en detaljerad bild av hur organ formas och växer, hur de påverkas av sjukdomar och hur läkemedel påverkar kroppens olika vävnader.
De kan också många gånger ersätta försöksdjur i tester och screening av hur olika ämnen påverkar kroppen, och därmed kan man dramatiskt minska antalet djurförsök.
Syftet med att skapa de små hjärnmodellerna är att jämföra organoider som framställs av cellerna från en frisk person med en hjärnmodell som bygger på stamceller från en individ med en neurologisk diagnos, till exempel autism eller schizofreni. Frågan är om man kan se någon skillnad i hur hjärnorganoiderna växer och utvecklas – om nervcellerna beter sig på ett avvikande sätt hos de personerna.
Det här är ett av många sätt att forska med hjälp av organoider, en metod som alltså gör det möjligt att studera processer hos människan som är svårt att göra på andra sätt. Det går ju inte att ta vävnadsprover i hjärnan på levande människor. Det är också uteslutet att smitta en försöksperson med en allvarlig sjukdom i experimentsyfte.
Men med organoider kan man komma så nära det går.
– Organoiderna är fantastiska verktyg, säger virusforskaren Ali Mirazimi. De tar oss ett steg närmare det verkliga livet.
Kartlägger hur viruset angriper oss
Ali Mirazimi är adjungerad professor på Karolinska Institutet och jobbar också på Statens Veterinärmedicinska Anstalt (SVA) och Folkhälsomyndigheten. Han forskar till vardags på några av de mest omskrivna och fruktade virus vi känner till, som ebola och zika. Just nu, våren 2020, arbetar han förstås även med coronaviruset.
Ambitionen är att kartlägga hur dessa virus beter sig för att angripa våra celler.
– Tidigare använde vi celler odlade på plattor. Det blir tvådimensionellt och cellerna har kontakt bara på en yta. Cellerna beter sig helt annorlunda i tre dimensioner; det blir en blandning av celler som kommunicerar med varandra på ett sätt som liknar verkligheten. Vi får ny kunskap, helt enkelt.
Minskar antalet djurförsök
Det handlar också om att ta fram läkemedel, så kallade antivirala medel. Utan organoider hade det krävt betydligt fler försöksdjur – oftast möss – som först utsätts för virus och sedan ett läkemedel som testas. Nu kan man göra det på organoider istället.
Med hjälp av små modeller av flera typer av organ – lungor, njurar eller tarm, till exempel – så testar man hur möjliga botemedel fungerar. Först infekterar man organoiderna med viruset, sedan kan man snabbt testa stora mängder av dem för att se hur de reagerar, och hur medlet biter på viruset. Just nu används organoiderna också för att ta fram läkemedel, antiviraler, mot det nya coronaviruset som ligger bakom covid-19-pandemin.
Ali Mirazimi och hans medarbetare använder också hjärnorganoider från kollegan Anna Falks laboratorium. Med hjälp av cellmodeller av hjärnan har forskare tidigare till exempel sett hur zika-viruset angriper hjärnan hos växande foster, något som drabbade många barn under zika-epidemin i Sydamerika 2016.
Imiterar även djurorgan
Organoider kan inte bara imitera mänskliga organ. Ali Mirazimi på SVA är också intresserad av sjukdomar hos boskap. Han arbetar därför med organoider av tarmar från kor. Med dem kan han studera hur virussjukdomen Rift Valley-feber angriper djur i östra Afrika.
I Holland har forskare skapat organoider av organ från ormar. Det visar sig att cellerna hos reptilerna kan styras om och användas på samma sätt som de mänskliga. Med organoider av giftkörtlarna hos vissa ormar har de visat hur man kan ta fram serum mot ormbett, helt utan att behöva hantera giftiga ormar i laboratoriet.
Även på Scilife Lab i Uppsala pågår forskning ned organoider. Mikael Sellin forskar om molekylära mekanismer vid bakteriell tarminfektion vid Uppsala universitet. Där odlas organoider av tarmvävnad för att få en inblick i det som annars sker i matsmältningssystemets ständiga mörker. På så vis kan forskarna studera exakt vad som händer när tarmen hos en människa infekteras av bakterier.
Deras organoider är millimeterstora klot som består av några tusen celler som organiserat sig till en miniversion av hur tarmväggen ser ut.
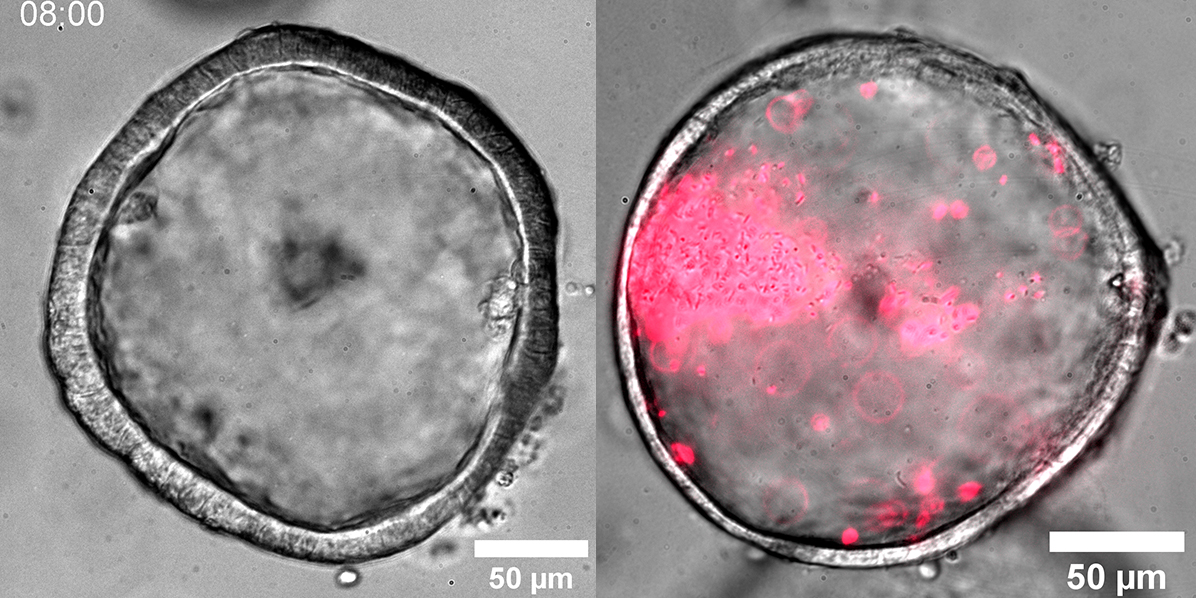
Infektionens väg kan följas
I mikroskopets förstoring syns hur en tunn glasnål, smalare än ett hårstrå, injicerar en välavvägd dos på hundra Salmonellabakterier in i cellklotet. Bakterierna, som lyser ilsket rött, lyckas snabbt bita sig fast i en fläck och snart har de totalt övermannat de gröna tarmcellerna. Efter en stund kan tarmens celler inte hålla emot längre. Den aggressiva infektionen spränger till slut sönder organoiden.
– Organoiden är som en riktig tarm, med de olika typer av ytceller som finns i våra tarmar, säger Mikael Sellin. Bara med den skillnaden att den saknar vår naturliga flora av tarmbakterier. Vi kan se vilka mekanismer bakterierna använder för att ta sig in i cellerna, och vi ser det i 3D och i realtid, både allvarliga akuta infektioner och mer långsamma angrepp.

Den här processen kan man sedan upprepa i olika versioner, med andra typer av bakterier, till exempel Shigella eller E-coli som kan orsaka allvarliga tarminfektioner. Symtomen är ofta kräkningar och diarréer som kan pågå i veckor. I riktigt allvarliga fall av Salmonella kan den som drabbas få tyfoidfeber, en sjukdom som orsakar hundratusentals dödsfall i världen varje år.
Ett problem med de här bakterierna är att de är svåra att slå ut med antibiotika. Och man vet inte hur gör de för att ta sig förbi det försvar mot angrepp som vår egen tarmflora av bakterier utgör. Målet är att lära sig hur infektionerna kan bekämpas med andra medel än antibiotika.
Mikael Sellin är lite förtegen om resultaten eftersom mycket ännu är opublicerat, men några iakttagelser kan han berätta om.
– Vi har till exempel hittat en delförklaring till hur bakterierna överlever antibiotikabehandling. Hur de tränger ner i djupare vävnadslager så att det alltid blir några som klarar sig. Vi har också upptäckt en försvarsmekanism hos våra celler, hur cellerna i tarmens ytlager startar ett självmordsprogram när de känner av en infektion, och när de dör spottar de samtidigt ut bakterieceller så att bakterierna sköljs ut ur tarmen via den naturliga utgången. Det är en upptäckt som vi har gjort nyligen och nu följer upp.
Har begränsad livslängd
Organoiden som verktyg skiljer sig på ett viktigt sätt från ett riktigt organ: De saknar blodkärl. Det betyder att de innersta cellerna i organoiden hela tiden dör efterhand i brist på näring. Organiden har därmed en begränsad livslängd och kan inte bli särskilt stor.
Det pågår mycket arbete över hela världen för att lösa problemet, och kanske organoiderna i framtiden kan bli betydligt större och mer och mer lika verkliga organ med ett system för att ta upp näring och syre från omgivningen.
Men om målet är att organoiderna ska bli så lika ett riktigt organ som möjligt, hur lik en hjärna kan då exempelvis de små riskornen i Anna Falks skålar bli? Kan de till slut börja tänka?
– Det är både en teknisk och en etisk fråga, säger hon. En hjärna behöver ju kontakt med omvärlden för att utvecklas och behöver också förmedla signaler, och det gör de ju inte än. Och det handlar inte om en hel hjärna. Vi gör enbart en liten del – cortex, det vill säga hjärnbarken. Om man kombinerar fler komponenter så kan det kanske hända nya saker. En organoid med synceller kan ju kopplas till en minihjärna som då kan se någonting och kanske skapa ett minne av det. I så fall börjar vi närma oss mer av ett etiskt dilemma.
Är det möjligt att komma så långt då?
– Det är ju så med vetenskap att vi forskare aldrig slutar att vara nyfikna på vad som går att göra. Det krävs att de etiska diskussionerna fortsätter, och att lagar och regler hänger med. Forskningen kommer hela tiden att fortsätta vidare, men inom de regler som samhället sätter upp, säger Anna Falk.
Text: Tomas Lindblad på uppdrag av forskning.se
Så skapas nya stamceller
2012 fick den japanske forskaren Shinya Yamanaka nobelpriset i medicin för sin upptäckt att man genom att tillsätta fyra tillväxtfaktorer kan få en cell att backa i utvecklingen och bli en stamcell, det vill säga en cell som kan utvecklas till nästan vad som helst.
Idag är det standard i världens forskningslaboratorier att ta till exempel en vanlig hudcell, förvandla den till en stamcell genom att tillsätta Yamanakas fyra faktorer och sedan ”styra om” den till att bli något helt annat, till exempel en tarmcell eller en nervcell. Varje utvecklingsväg har sina speciella recept av tillväxtfaktorer som har arbetats fram under de senaste åren och idag kan man skapa de flesta celltyper ur en inducerad stamcell.
De omstyrda cellerna kan sedan organisera sig själva till mer eller mindre komplexa strukturer som på många sätt liknar ett riktigt organ.








